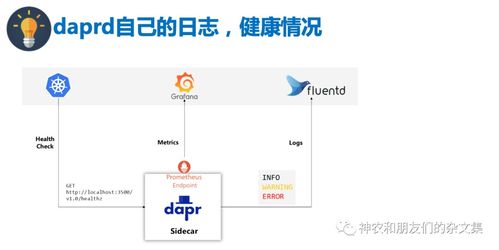
醫(yī)療器械飛行檢查(以下簡稱“飛檢”)是國家藥品監(jiān)督管理部門對醫(yī)療器械生產(chǎn)、經(jīng)營、使用單位實施的不預(yù)先告知的突擊性監(jiān)督檢查,是保障醫(yī)療器械安全有效的重要手段。隨著醫(yī)療器械信息化、智能化程度的不斷提高,計算機軟硬件及輔助設(shè)備在醫(yī)療器械經(jīng)營,尤其是零售環(huán)節(jié)的應(yīng)用日益廣泛,這也成為飛檢的重點關(guān)注領(lǐng)域。本文旨在梳理該環(huán)節(jié)的常見問題,并結(jié)合案例進行分析,為相關(guān)企業(yè)提供合規(guī)參考。
一、 計算機軟硬件及輔助設(shè)備零售環(huán)節(jié)飛檢常見問題
- 資質(zhì)與許可問題:
- 超范圍經(jīng)營:企業(yè)持有的《醫(yī)療器械經(jīng)營許可證》經(jīng)營范圍未包含“醫(yī)用軟件”、“醫(yī)用計算機”或特定管理類別的計算機輔助診斷設(shè)備等,卻實際銷售此類產(chǎn)品。
- 資質(zhì)審核不嚴(yán):采購的計算機軟硬件及輔助設(shè)備(如醫(yī)用顯示器、數(shù)據(jù)采集卡、專用分析軟件等)供應(yīng)商或生產(chǎn)商不具備相應(yīng)的醫(yī)療器械生產(chǎn)/經(jīng)營資質(zhì),或產(chǎn)品未取得醫(yī)療器械注冊證/備案憑證。
- 采購與驗收管理問題:
- 采購記錄不完整:未能提供完整的采購合同、發(fā)票、隨貨同行單,特別是軟件授權(quán)協(xié)議、技術(shù)規(guī)格書等關(guān)鍵文件缺失。
- 驗收流程形同虛設(shè):未建立或未嚴(yán)格執(zhí)行針對計算機軟硬件及輔助設(shè)備的驗收規(guī)程。例如,未核對軟件版本號、注冊碼與注冊證信息是否一致;未對硬件的關(guān)鍵性能參數(shù)(如醫(yī)用顯示器的分辨率、亮度一致性)進行驗證并記錄。
- 儲存與養(yǎng)護問題:
- 儲存條件不當(dāng):對溫濕度敏感的硬件設(shè)備(如某些傳感器、精密電路板)或存儲介質(zhì)(如含有軟件的加密狗、光盤),未按規(guī)定條件儲存。
- 軟件介質(zhì)管理混亂:安裝光盤、授權(quán)密鑰、升級U盤等未作為重要物料進行專門管理,記錄不清,存在丟失或混淆風(fēng)險。
- 銷售與售后服務(wù)問題:
- 未建立銷售記錄或記錄不準(zhǔn)確:銷售時未記錄產(chǎn)品序列號、軟件版本號、終端用戶信息等,導(dǎo)致產(chǎn)品不可追溯。特別是軟件,未記錄授權(quán)安裝的終端信息。
- 培訓(xùn)與技術(shù)支持缺失:銷售復(fù)雜軟硬件系統(tǒng)(如遠(yuǎn)程診斷系統(tǒng)、影像處理工作站)時,未向用戶提供必要的安裝、操作、維護培訓(xùn),或培訓(xùn)記錄缺失。
- 售后更新升級不合規(guī):提供的軟件升級包未進行注冊變更或備案,或升級操作未經(jīng)用戶確認(rèn)、未記錄版本變更日志。
- 質(zhì)量體系文件與記錄問題:
- 制度缺失或與實際脫節(jié):質(zhì)量管理制度中缺乏針對計算機軟硬件產(chǎn)品的專項管理要求,如《計算機軟件管理制度》、《數(shù)據(jù)安全管理規(guī)程》等。
- 記錄缺乏可追溯性:從采購、入庫、調(diào)試、銷售到售后服務(wù)的全鏈條記錄未能有效關(guān)聯(lián),無法實現(xiàn)“向前可溯、向后可追”。
二、 典型案例分析
案例一:銷售未取得醫(yī)療器械注冊證的“AI輔助診斷軟件”
案情:某醫(yī)療器械零售企業(yè)向基層診所銷售一款聲稱具有肺部影像AI輔助診斷功能的軟件。飛檢發(fā)現(xiàn),該軟件被包裝為“計算機輔助工具”,但實際用途符合醫(yī)療器械定義,且未取得醫(yī)療器械注冊證。
問題點:企業(yè)將應(yīng)按第二類醫(yī)療器械管理的軟件,作為普通計算機軟件進行銷售,屬于經(jīng)營未依法注冊的醫(yī)療器械。
* 分析與啟示:企業(yè)必須準(zhǔn)確識別所售產(chǎn)品的屬性。任何預(yù)期用于疾病診斷、預(yù)防、監(jiān)護、治療的計算機軟件,均應(yīng)依據(jù)《醫(yī)療器械分類目錄》判斷其類別并取得相應(yīng)資質(zhì)。不能以“技術(shù)工具”為名規(guī)避監(jiān)管。
案例二:醫(yī)用顯示器采購驗收記錄不全,性能未驗證
案情:飛檢某經(jīng)營醫(yī)用顯示器的企業(yè),抽查其入庫驗收記錄。記錄僅顯示“數(shù)量一臺,外觀完好”,但缺少對產(chǎn)品序列號的登記,更無亮度、對比度、分辨率等關(guān)鍵醫(yī)用性能的驗證記錄。企業(yè)無法證明入庫產(chǎn)品符合醫(yī)用標(biāo)準(zhǔn)。
問題點:驗收流于形式,未針對醫(yī)療器械的特殊性能要求進行驗證,質(zhì)量管控失效。
* 分析與啟示:對于計算機硬件類醫(yī)療器械,驗收必須基于其技術(shù)標(biāo)準(zhǔn)和注冊要求。應(yīng)制定詳細(xì)的驗收規(guī)程,并使用必要的檢測工具(如亮度計)進行驗證,形成可追溯的記錄。
案例三:軟件升級服務(wù)未納入質(zhì)量管理體系
案情:某企業(yè)銷售一款醫(yī)療器械管理軟件。飛檢查閱售后服務(wù)記錄時發(fā)現(xiàn),其為客戶提供了多次版本升級,但升級包來源不明,升級過程未經(jīng)客戶書面確認(rèn),也無升級后版本確認(rèn)記錄。企業(yè)稱“這只是技術(shù)服務(wù),不是銷售醫(yī)療器械”。
問題點:將軟件的維護升級排除在質(zhì)量管理體系之外,導(dǎo)致變更失控,可能引入安全風(fēng)險。
* 分析與啟示:醫(yī)療器械軟件的維護、升級是質(zhì)量體系的重要組成部分。企業(yè)應(yīng)建立控制程序,確保升級活動經(jīng)過評估、驗證和批準(zhǔn),并保留完整的記錄。若升級涉及功能重大變更,需關(guān)注注冊證是否需要變更。
三、 與建議
對于從事計算機軟硬件及輔助設(shè)備零售的醫(yī)療器械經(jīng)營企業(yè),應(yīng)對飛檢風(fēng)險,關(guān)鍵在于:
- 強化產(chǎn)品屬性識別:在引入任何軟硬件產(chǎn)品前,務(wù)必進行醫(yī)療器械屬性判定,確保資質(zhì)齊全。
- 完善專項管理制度:建立涵蓋軟件授權(quán)管理、硬件性能驗證、數(shù)據(jù)安全、升級維護等環(huán)節(jié)的專項制度。
- 落實全流程記錄:確保從供應(yīng)商審核到最終用戶服務(wù)的每一個環(huán)節(jié)都有清晰、準(zhǔn)確、可關(guān)聯(lián)的記錄,特別是序列號、版本號等唯一性標(biāo)識。
- 加強人員培訓(xùn):對采購、驗收、銷售、技術(shù)支持人員進行醫(yī)療器械法規(guī)及專業(yè)知識的持續(xù)培訓(xùn),提升合規(guī)意識和專業(yè)能力。
通過系統(tǒng)性梳理問題并借鑒典型案例,相關(guān)企業(yè)可以更有針對性地完善自身質(zhì)量管理體系,從容應(yīng)對飛行檢查,保障經(jīng)營活動的合規(guī)性與安全性,最終維護公眾用械安全。